基于RNA干扰的杀菌剂开发及其对化学杀菌剂的影响
引言
RNA干擾(RNA interference,縮寫為RNAi)是指由RNA(細胞內源或外源)誘發的基因沉默現象,其機制是短的反義RNA通過阻礙與其有互補序列基因的轉錄或翻譯來抑制基因的表達。近年來,基于RNAi機制的有害生物防治策略發展迅速,用于防治有害生物的RNA分子制劑被稱為核酸農藥。相比于傳統的小分子農藥,核酸農藥靶標特異性強,無殘留,且開發成本遠低于化學農藥,符合當今社會對于環境友好型農藥的要求。2018年,美國食品藥品監督管理局批準了第1個基于RNAi的藥物——ONPATTRO,該藥物可治療伴有多發性神經疾病的遺傳性轉甲狀腺素蛋白淀粉樣變性(hATTR),這標志著RNAi技術的應用進入一個新時代。在農業領域,首個在美國國家環境保護署(EPA)獲批的核酸農藥產品是表達DvSnf7雙鏈RNA的轉基因玉米,用以防治西方玉米根蟲Diabrotica virgifera LeConte(western corn rootworm,WCR),該產品計劃于2024上市(https://traits.bayer.com/corn/Pages/SmartStax-PRO.aspx)。近期,拜耳集團采用RNAi技術生產的VT4PRO?玉米也獲得了EPA的商業登記,最早將于2024年在美國上市。雖然RNAi防治有害生物的技術正處于商業開發的熱點階段,但若實現其大規模應用還需要解決一些阻礙,例如RNA遞送至靶細胞的效率問題、靶標基因的沉默效率問題、劑量限制性毒性和干擾效率不足以及RNA分子的穩定性和持效性等。就防治病原微生物的核酸殺菌劑而言,雖然已有文章報道在實驗室條件下,體外或體內應用合成的長雙鏈RNA(double-stranded RNA, dsRNA)或小干擾RNA(small interfering RNA, siRNA)可以下調微生物中靶標必須基因的表達,從而實現防控卵菌、真菌和病毒病原體,但是其防治效果與穩定性方面表現得較為復雜。本文擬從RNAi的發展歷程中探尋那些改變核酸殺菌劑發展方向的重要事件,從理論與技術角度分析核酸殺菌劑目前存在的問題與障礙,通過比較化學殺菌劑與核酸殺菌劑的優缺點闡述核酸殺菌劑的發展對化學殺菌劑市場的影響。
1 RNAi研究的發展歷程
RNAi現象是Fire等在對秀麗隱桿線蟲Caenorhabditis elegans的研究中發現并揭示的。該生物現象的發現解釋了之前在植物、真菌和動物中觀察到的令人困惑的基因沉默現象。隨后,RNAi現象被證實在多種生物中廣泛存在,但是不同物種間RNAi核心元件的起源和生物合成存在較大差異,這引發了科研人員的研究興趣。目前人們普遍認為19~30 nt的非編碼小RNA(small RNAs, sRNAs)在RNAi過程中發揮著重要作用。sRNAs根據來源、結構和生物作用可分為3類:小干擾RNAs(siRNAs)、微小RNAs(microRNAs,miRNAs)和piwiRNAs(piwi-interacting RNAs,piRNAs)。大多數真菌的sRNAs為siRNAs。生物體內的RNAi過程大致可分為起始、效應和級聯放大3部分。2001年,科研工作者發現Dicer酶是RNAi起始步驟的關鍵酶,Dicer將長dsRNA剪切加工為成熟的siRNA;然后,siRNA單鏈被加載到具有核酸內切活性的Argonaute蛋白上,形成RNA誘導的沉默復合物(RNA-induced silencing complex,RISC)。siRNA與互補的信使RNA(messenger RNA, mRNA)結合后,靶標mRNA會被Argonaute直接剪切或介導RISC對mRNA的翻譯抑制。研究者隨后發現,RNA依賴性RNA聚合酶(RNA-dependent RNA Polymerase,RdRP)參與次級小RNA的產生與復制,進一步增強和放大了沉默效應。在植物和秀麗隱桿線蟲C. elegans中,RdRP可在靶RNA模板上形成合成sRNA或dsRNA的擴增環,起到級聯放大的作用。隨著研究的逐漸深入,RNAi成為哺乳動物、植物、線蟲、真菌和卵菌基因功能研究的重要工具。RNA在生物體內有效的傳遞與運輸是RNAi應用于醫藥和農業領域的前提。大量研究表明,sRNA可以在相互作用的生物體內傳遞(例如植物-真菌),進而誘導彼此的基因沉默,該機制被稱為跨界RNA干擾。dsRNA或sRNA只有進入細胞中才能發揮出高效的沉默效率,不同生物對dsRNA或sRNA的攝取機制存在差異。在秀麗隱桿線蟲C. elegans中,dsRNA的吸收主要是通過SID跨膜蛋白家族。SID-2基因編碼一種跨膜蛋白,通過內吞作用十分緩慢地攝取dsRNA,而SID-1基因產物與內吞作用無關,主要參與質膜中快速轉運和通道的形成。昆蟲細胞攝取dsRNA的機制現已基本確定為網格蛋白依賴性內吞作用。棉鈴象鼻蟲Anthonomus grandis中dsRNA的細胞攝取與大胞飲作用相關。到目前為止,雖然有文章報道網格蛋白介導的內吞作用參與了核盤菌對dsRNA的攝取,但真菌吸收dsRNA或sRNA的具體機制仍不清楚。這也限制了核酸農藥在真菌防控方面的發展。
RNAi藥物首先在醫藥領域得到發展。2003年,siRNA首次作為藥物應用于哺乳動物,其治療潛力一度成為多家公司的研究熱點。然而,首批siRNAs臨床試驗RNAi效果不顯著并伴隨不確定的干擾效應,試驗中也出現了與免疫相關的毒性,最終以失敗告終;隨后第2波的臨床試驗研究發現,系統應用siRNA納米制劑能對人體產生效果,但是藥效一般,同時表現出明顯的劑量限制性毒性和療效不足的問題。鑒于RNAi藥物的負面作用,21世紀10年代初大型制藥公司退出了RNAi藥物研究領域,這對該行業造成極大的打擊。但是,一些較小的RNAi藥物公司和科研人員一直堅持改進siRNA的遞送、序列選擇、化學配方和輸送機制等技術,并取得了一定的進展。2018年,RNAi藥物ONPATTRO(patisiran)得到美國食品藥品監督管理局(FDA)和歐洲藥品管理局(EMA)的批準,該類新siRNA藥物主要用于治療遺傳性轉甲狀腺素淀粉樣變性病。最近,FDA和EMA批準吉夫拉里(Givlaari?)作為第2個RNAi藥物用于治療急性肝卟啉癥(AHP)成人患者。多種適用于肝臟、腎臟和眼部疾病的候選藥物正處于Ⅰ、Ⅱ和Ⅲ期臨床試驗中,RNAi醫藥重新成為研究焦點。
基因工程(genetic engineering,GE)的迅速發展使得RNAi相關藥品在農業領域中發展迅速,核酸農藥應運而生。針對有害生物的RNAi技術可以通過不同的方式實現,包括通過宿主誘導的基因沉默(host-induced genesilencing,HIGS)、噴霧誘導的基因沉默(spray-induced gene silencing,SIGS)以及病毒誘導的基因沉默(virus-induced gene silencing,VIGS)。農業領域首個商業化RNAi產品是可以表達dsRNA的轉基因玉米,通過表達靶向Snf7基因的發夾dsRNA來控制西方玉米根蟲。該商品于2017年獲得EPA批準,已經以商品名SmartStax Pro在2022年上市(https://traits.bayer.com/corn/Pages/SmartStax-PRO.aspx)。除此之外,一種靶向蛋白酶體亞基β5編碼基因(PSMB5)的長鏈dsRNA生物農藥活性成分,名為Ledprona,即將獲得美國EPA登記。
2 核酸殺菌劑在植物病害防控中的應用與瓶頸
在RNAi被用于病害防控的最初階段,RNAi對病毒性病害的防控是眾多研究者探究的熱點內容。科研人員分別開發了4類基于RNAi的抗病毒技術:正義鏈誘導的轉錄后基因沉默(S-PTGS)、發夾RNA誘導的PTGS(hp-PTGS)、人工miRNA誘導的PTGS(AMIR)和反式作用siRNA誘導的PTGS(TAS)。利用上述技術培育了可以表達sRNA的轉基因植株,并分別在實驗室和田間條件下進行了測試,發現部分轉基因植物獲得了對病毒的持久抗性。據國際農業生物技術應用收購服務(ISAAA)網站報道,數十種使用RNAi基因工程開發的抗病毒轉基因作物已獲準商業發行(http://www.isaaa.org/)。
在過去10年中,已有成功應用RNAi控制病原真菌和卵菌的報道。2010年,研究人員首次通過在轉基因煙草植株中表達dsRNA,成功沉默輪枝鐮刀菌Fusarium verticillioides轉基因菌株的β-glucuronidase(GUS)報告基因。隨后,有文章報道,在應用HIGS技術生產的轉基因小麥、大麥和擬南芥中小麥白粉病菌Blumeria graminis和禾谷鐮刀菌Fusarium graminearum的侵染速度變慢,采用同樣的方法還可抑制尖孢鐮刀菌Fusarium oxysporum對香蕉的侵染。在疫霉的RNAi研究中,轉基因dsRNA序列的穩定表達成功沉默了致病疫霉Phytophthora infestans和寄生疫霉Phytophthora parasitic的靶基因。但是,也有RNAi未起作用的報道,在表達PnPMA1 dsRNA的轉基因擬南芥中,HIGS介導的寄生疫霉沉默未能成功啟動。
由于轉基因植株培育時間較長,不需培育轉基因植株的噴霧誘導基因沉默(SIGS)逐漸步入人們視野。隨后,SIGS被證明可有效防治禾谷鐮刀菌F. graminearum、灰霉病菌Botrytis cinerea和油菜菌核病菌Sclerotinia sclerotiorum等。研究發現,外源噴施dsRNA對于防治灰霉病菌、菌核病菌、立枯絲核菌Rhizoctonia solani、黑曲霉Aspergillus niger和大麗輪枝菌Verticillium dahliae效果較好,但對于卵菌(如致病疫霉)效果一般。dsRNA可以通過根或樹干進入植物維管系統(木質部和韌皮部),但其通過不同植物組織的吸收效率不同。南京農業大學殺菌劑生物學團隊證明了小麥胚芽鞘完整表面較難吸收dsRNA,而創面則能有效吸收dsRNA。
盡管有關RNAi技術的基礎研究熱度不斷提升,但是其大規模應用仍有很多需要克服的難關。常見的阻礙有脫靶效應、RNA分子的穩定性和成本等。本文將著重分析影響RNAi效率的因素,雖然這些觀點與前人的觀點存在些許差異,但是可以解釋RNAi殺菌劑商業化難的原因。由于作用機制不同,我們將分開討論HIGS和SIGS中RNAi效率影響因素。
首先介紹HIGS中RNAi效率的影響因素。HIGS中,RNA分子是由轉基因植株產生的,因此其siRNA濃度是由植物RNAi系統相關酶及dsRNA的表達程度決定的。許多因素可以影響植物中dsRNA的表達,如啟動子強度、dsRNA的長度和結構以及植物基因組的特征。在大多數研究中,科研工作者采用組成型強啟動子轉錄dsRNA,并利用內含子間隔正義和反義RNA序列,形成發卡結構RNA(HairpinRNA, hpRNA),以期高效表達dsRNA。然而,有研究發現,這種傳統的hpRNA設計會造成dsRNA轉錄的自沉默,而用胸腺嘧啶替代胞嘧啶可以防止自沉默,且不影響hpRNA的形成,達到高效沉默的目的。值得注意的是,不同真核生物的Dicer蛋白家族在結構域的結構和分子功能上表現出明顯的多樣性。不同物種中的Dicer和DCL(Dicer-like protein)在RNA靶標偏好、siRNA產物長度和特定相互作用對象方面也存在差異。因此,盡管dsRNA相同,植物細胞與真菌細胞體內切割產生的siRNA卻不同。所以,當植物產生的siRNA被真菌吸收并利用真菌Argonaute蛋白誘導RNA沉默時,RNAi效率可能會降低(圖1)。有報道稱,靶向相同基因的dsRNA和siRNA都可以降低基因表達,但在赤擬谷盜Tribolium castaneum Herbs中,只有使用dsRNA才能觀察到RNAi介導的表型變化。事實上,高濃度siRNA并不代表擁有高效率RNAi。這是因為HIGS的觸發主要決定于siRNA的吸收濃度。雖然植物可以通過細胞外囊泡向病原真菌運送sRNA,但除此之外,真菌中的RNAi效率還會受到siRNA特性的影響。研究者發現,由于植物質體中不存在RNAi,因此在植物質體中表達dsRNA可以排除植物RNA干擾相關元件對dsRNA的切割,從而避免與不同物種間RNAi的差異性,這或許可以解決由siRNA差異導致的RNAi效率差的問題。除了技術因素之外,基于HIGS的轉基因作物產業化還受到國家政策的限制。HIGS類轉基因作物在抗蟲、抗病上存在較大優勢,但也存在一些隱患,例如基因漂流、基因污染、抗生素標記基因轉移等。因此,我國對轉基因作物產業化十分謹慎,并制定了相關轉基因法律法規和管理規范進行風險控制。
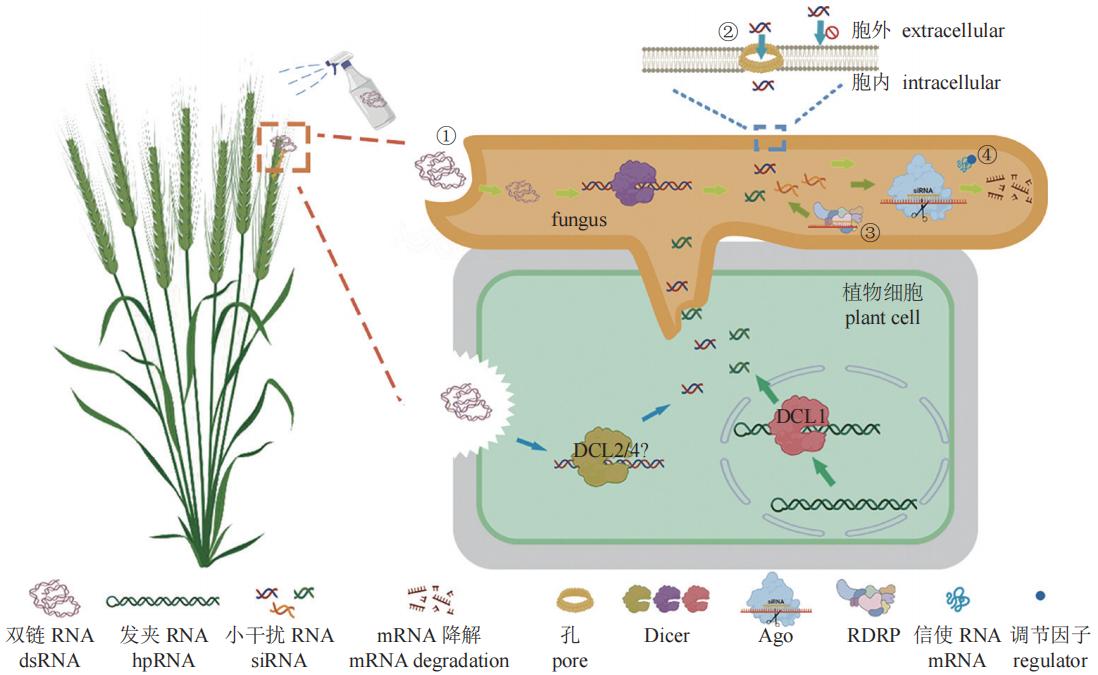
宿主誘導的基因沉默(HIGS)中,植物細胞核中產生發夾(hpRNA),經DCL1切割后產生siRNA,siRNA進入真菌細胞后發揮作用。噴霧誘導基因沉默(SIGS)中,一部分的dsRNA進入植物細胞中,經DCL2/4(具體機制未知)切割后產生siRNA,siRNA同樣進入真菌細胞中發揮作用;另一部分的dsRNA經胞吞作用直接進入真菌細胞中,經Dicer切割后產生siRNA,siRNA與互補的mRNA結合后,靶標mRNA會被沉默復合體(RISC)剪切,最終mRNA降解。影響RNAi效率的主要因素:①真菌菌絲主要通過菌絲頂端的內吞作用攝取dsRNA,攝取效率有限;②siRNAs分子量較大,不可直接通過細胞壁細胞,可能通過細胞壁上的孔隙進入胞內,效率低;③RNA依賴性RNA聚合酶(RdRP)參與次級小RNA的產生與復制,進一步增強和放大沉默效應。不同生物中RdRP擴增效率相差較大;④真菌中存在其它可以影響RNAi效果穩定性的調節因子。
圖1 影響RNAi效率的因素
最新研究表明,SIGS中RNAi效率影響因素比HIGS中更復雜。噴施在植物表面的dsRNA分為直接和間接兩種方式進入真菌體內:直接途徑為RNA直接被真菌細胞吸收;間接途徑為RNA首先被植物細胞吸收,然后運輸到真菌細胞中。不同途徑吸收的RNA以不同的機制發揮作用,真菌細胞直接吸收的RNA直接引發了真菌RNAi機制;而植物細胞吸收的RNA先引發了植物RNAi機制,進而引發了真菌的RNAi機制(圖1)。如前文所述,噴灑在胚芽鞘完整表面的dsRNA不能被胚芽鞘吸收,而可能是直接被真菌細胞吸收。因此,dsRNA只可在短時間內發揮作用,并不能提高植物的抗病能力。南京農業大學殺菌劑生物學團隊發現亞洲鐮刀菌F. asiaticum中由dsRNA引發的RNAi效應僅可持續約9 h,這是因為亞洲鐮刀菌無法擴增產生次級siRNA。siRNA在生物體內的二次擴增與RdRP直接相關,RdRP通過將單鏈RNA轉化為dsRNA或合成siRNA來進一步增強和放大RNAi效果。迄今為止發現的所有RdRP都是從一個祖先RdRP進化而來,在植物、真菌和部分動物中發現了許多同源物。在許多后生動物中也發現了RdRP的同源物,比如線蟲綱(秀麗隱桿線蟲)、刺胞動物門(水螅Hydra)、螯肢動物亞門(蜱Tick)、半索動物門(囊舌蟲Acornworm)、尾索動物亞門(海鞘Seasquirt);但在其他類群中,例如扁形動物門(渦蟲Planaria)、六足亞門(果蠅Drosophila)或脊椎動物門(脊椎動物Vertebrates)等基因組中卻無發現。有趣的是,禾谷鐮刀菌F. graminearum中至少存在5個RdRP,但其siRNA的二次擴增并不充分。此外,dsRNA的遞送效率和穩定性同樣影響RNAi效率,這是因為dsRNA在遞送至靶標生物的過程中十分容易受到酶或pH值等因素的影響而降解。為了解決此類問題,科研人員將核酸序列包埋在特定的材料中,形成核酸-材料復合體,不僅成功提高了核酸穩定性、增加了遞送效率,有些材料還可以起到增效的作用。目前常見的包被系統為脂質體、病毒樣顆粒、復合納米顆粒和生物粘土,根據待遞送的RNA類型、靶生物及其攝取機制選取合適的包被系統。
從上文中我們不難看出,HIGS和SIGS最終的關鍵步驟均為誘導真菌細胞的基因沉默。但是,dsRNA或sRNA分子進入真菌時會被細胞壁和細胞膜阻隔。真菌細胞壁在真菌與環境的相互作用中發揮著重要作用。真菌細胞壁結構比較復雜,通常由幾丁質、β-1,3-和β-1,6-葡聚糖、甘露聚糖和蛋白質組成,不同真菌細胞壁組成成分差異較大。以釀酒酵母Saccharomyces cerevisiae為例,甘露糖蛋白是酵母細胞壁的重要組成成分,決定了細胞壁的孔隙度,研究表明,在分子自然折疊的情況下,酵母細胞壁可阻擋大于600 Da的分子進入。20-nt siRNA的分子質量約為6,569 Da,在自然折疊的情況下,分子粒徑遠大于細胞壁的孔隙度。這也就意味著,dsRNA或sRNA很難通過正常的細胞壁表面進入細胞內。之前的研究表明,除非使用轉化技術,如原生質體介導的轉化、農桿菌介導的轉化、電穿孔、生物方法和沖擊波介導的轉化,否則幾乎不可能將遺傳信息(質粒或基因)運輸到真菌細胞中。但是,這并不意味著sRNA或dsRNA絕對不能穿過細胞壁。研究表明,釀酒酵母表面分布有直徑在50~250 nm之間的孔隙。351個核苷酸的RNA平均截面長度為(43.6±4.6)nm,頭部直徑測量為(17.0±3.6)nm。如此看來,短一些的dsRNA和sRNA有可能通過孔隙進入真菌細胞(圖1),但是據我們觀察這個效率極低。
在許多真核生物中,胞吞作用也參與了dsRNA的攝取。最近的研究證實,核盤菌中dsRNA的攝取是通過網格蛋白介導的內吞作用發生的。內吞作用是生物體內重要的生物活動,指的是通過質膜的變形運動將細胞外物質轉運入細胞內的過程。強有力的證據表明,內吞作用在菌絲頂端占主導地位,在快速生長的菌絲中,肌動蛋白斑塊集中在菌絲頂端,形成一個頂端下環,與分泌為主的尖端空間耦合。因此,快速延伸的菌絲頂端具有更有效的內吞作用。我們的研究結果與上述理論一致,Myo5-8 dsRNA誘導的表型出現在亞洲鐮刀菌和禾谷鐮刀菌菌絲頂端。據報道,RNAi信號可以在植物不同細胞間轉移,但在禾谷鐮刀菌中,大多數RNAi相關表型仍表現在頂端細胞中。
除此之外,真菌中還存在其他可以影響RNAi效率的因素。之前的研究表明,將dsRNA負載于納米顆粒上可提高其穩定性和效果。但是,增強dsRNA的穩定性并不能完全提高RNAi效率的穩定性,這是因為還存在另外可以降低RNAi效率的復雜機制。在這里,我們討論的RNAi效率的穩定性并不是指體外合成的dsRNA或sRNA分子的穩定性,而是體內RNA干擾效率的穩定性,即對靶基因的沉默效率穩定性。RNAi效率受多種因素影響,同一物種的不同轉錄本及基因型、同一轉錄本的不同區域,甚至是觀察表型效果的不同時間都有可能觀察到不同的RNAi效率。在精心控制試驗變量的條件下,經常會得到重復率低甚至前后矛盾的結果。研究發現,靶標mRNA的表達調控、靶標mRNA的二級結構、sRNAs的數量與序列特異性,以及dsRNA效應因子等因素都可以影響RNAi效率。首先,不同的mRNA在豐度、表達時間和空間上存在顯著差異。不難想象,如果靶標mRNA表達高且易變,那么它就不容易被沉默。對鱗翅目昆蟲的RNAi試驗分析顯示,在130個被測試的基因中,高水平沉默的占38%,低水平沉默的占14%,完全沒有沉默的占48%。其次,基因沉默效率與靶標位點局部的mRNA結構呈負相關,該結構可以通過氫鍵(H-b)指數(結構因子的單一參數)來表征。這也就解釋了為什么dsRNA或siRNA的基因沉默效率會因mRNA的靶向位置而產生巨大的差異。有趣的是,所有關于dsRNA位置效應的報道都有一個共同點——沒有在dsRNA同源區域之外發現siRNA。再者,有效切割的必備條件為堿基配對序列的中間序列完全互補(種子序列),只有完全互補才能被PIWI域切割。這一點在同為小分子RNA的miRNA動力學研究中被證實。通過miRNA動力學分析可得出,低豐度的miRNA一般不能產生有生物學意義的調控,因為它們的濃度低于核心匹配靶點的解離常數(Kd值)(小鼠AGO2為3.7 pmol/L,果蠅AGO2為20 pmol/L)。最后,RNAi過程還受到其他因素的調控,如siRNA降解酶和RNAi調節因子ERI-1至ERI-9。到目前為止,尚不清楚調控RNAi效率變化的真正機制。
3 核酸殺菌劑對傳統殺菌劑的影響
目前,生產中植物病原真菌的防治主要依靠化學殺菌劑,但因其使用時間長、使用范圍廣等,導致農藥殘留、抗藥性等負面問題頻發。基于RNAi的核酸農藥特異性高、無殘留,更符合當今社會對于環境友好農藥的需求,因此成為潛在的新型綠色植保產品,引起了當前市場趨勢的變化。
首先,核酸農藥可以減少農藥用量并可治理有害生物抗藥性。核酸農藥的應用可以降低田間化學農藥的用量。由于廣譜性化學農藥大范圍的頻繁使用,導致有害生物抗藥性問題頻發,化學農藥的防治效果不斷下降。此外,抗藥性問題還會引發突發性的防治失敗,造成農產品產量下降甚至絕收,給農業生產和糧食安全帶來嚴峻的挑戰。由于作用機制不同,RNAi可以用來治理有害生物對化學農藥的抗性問題。例如,通過Faβ2Tub-3 dsRNA沉默β2-tubulin可顯著降低真菌對多菌靈的抗性。更令人驚訝的是,多菌靈延長了Faβ2Tub-3 dsRNA的持效時間。同樣,應用dsRNA可以通過抑制鐮刀菌靶基因Myosin 5(Myo5)的表達,降低亞洲鐮孢菌的侵染以及對氰烯菌酯(殺真菌劑JS399-19)的抗性。還有另一個例子,RNAi能夠治理田間種群對殺蟲劑的抗性。西方玉米根蟲是一種適應性強的入侵害蟲,嚴重危害玉米,對幾乎所有的化學殺蟲劑都產生了抗藥性。目前已成功開發培育出表達vATPaseA dsRNA的轉基因玉米,可以有效控制西方玉米根蟲。這種基于RNAi技術的產品已獲得EPA批準。
然而,也要認識到核酸藥劑同樣存在抗藥性風險。基于抗藥性產生機制,結合RNAi的原理和特點,我們列出了3種可能影響RNAi效率的抗藥性機制:(i)靶基因變異。RNAi基因的多態性和突變可導致dsRNA和mRNA序列的不匹配,從而產生抗藥性。一個極端的例子是植物病原細菌和釀酒酵母S. cerevisiae,由于缺乏可識別的Argonaute、Dicer和RdRP同源物,對RNAi藥劑存在天然抗性。此外,RNAi基因的表達變化(如StauC、V-ATPase B和VATPase d)也可以改變細胞對RNAi藥劑的敏感性。(ii)靶標物種對dsRNA的吸收降低。最近的研究發現,不同真菌的RNA攝取效率不同。炭疽病菌Colletotrichum gloeosporioides不能吸收dsRNA,致病疫霉P. infestans不同細胞類型和發育階段吸收效率也各有不同。(iii)RNAi效率的穩定性。如前文所述,RNAi表型變化頻繁。在某些情況下,RNAi藥劑對真菌的藥效穩定性差。RNAi效率的不穩定性可能與已報道的RNAi元件無關,而與靶mRNA結構的調控有關。
其次,新型RNAi產品的開發速度要快于化學殺菌劑。與化學農藥相比,RNAi的研制過程相對簡單,研制成本較低。目前,因為新化學先導物的發現難度逐年增加,開發一種新型化學農藥需要花費近12年的時間,且成本超過2.8億美元。相比之下,在美國,開發RNAi藥劑的成本為300萬~700萬美元,上市時間為18~24個月。與化學藥劑相比,RNAi的候選物更易篩選。一旦該基因在真菌的生長、發育和致病性中起重要作用,靶向該基因的RNA分子就可能起到保護植物的作用。不過,RNA的合成成本高于化學殺蟲劑。但是隨著技術的發展,dsRNA的生產成本逐年降低,2008年的成本為1.25萬美元/g,2018年已降至60美元/g。2020年,RNAGri(一家生物技術公司,前身為APSE)專注于噸量級dsRNA的生產與純化,開發出一套由大腸桿菌生產APSE RNA容器(ARC)的系統,能夠大量生產封裝可直接噴霧的dsRNA,已將RNA生產成本降低到1美元/g。不久之后,Greenlight?系統將進一步把dsRNA合成成本降低到小于0.5美元/g(https://www.greenlightb iosciences.com/)。
最后,政府部門的投資在RNAi產品開發方面起著舉足輕重的作用。綠色、高效、環保是未來殺菌劑的發展趨勢。由于目前RNAi殺菌劑的大規模應用前景還不明朗,所以很難吸引到私營企業的投資。當前,大多數RNAi殺菌劑的項目都是由政府資金資助,由高校及研究所進行研究。不同收入國家政府部門在科學技術研發方面的投資存在差異。例如:中國、印度和巴西等政府大大提高了農業研究能力和農業產量,但撒哈拉以南的非洲政府對科研的投資總體上已停滯或呈下降趨勢。由于RNA藥物研究熱度的提升,全球從2018年開始,與RNAi殺菌劑相關的基礎研究大幅增加。
4 結論
RNAi是一項強有力的技術,不僅可以開發為新一代農藥單獨使用,還可以將RNAi藥劑與化學農藥結合使用,解決當前生產實際中的問題。盡管最近RNAi抗蟲產品已經獲得EPA的批準,但RNAi的大規模商品化仍面臨一些困難。在真菌中,dsRNA的攝取、遞送和RNAi的穩定性等RNAi相關機制仍未完全明確。開發RNAi生物殺菌劑作為一種有效且環境安全的植物病害防治方法是一個長期目標。在目前RNAi殺菌劑面臨各種障礙和問題的情況下,我們認為,最有可能實現的是將RNAi殺菌劑與化學殺菌劑協同使用,可以獲得最大效益。一方面可以減少化學農藥的使用量,一方面可以治理化學農藥抗藥性問題。首先,因為RNAi殺菌劑機理與化學殺菌劑不同,所以可以對已產生化學殺菌劑抗藥性的群體產生選擇壓,延緩抗藥性群體的擴展;其次,協同使用可能存在增效作用,減少藥量的同時可以提高RNAi和化學殺菌劑的防治效果;最后,由于RNAi殺菌劑一般是水溶性的,它可以減少化學農藥中溶劑、添加劑和其他化學品的使用。總之,核酸農藥是適應未來農業發展方向的極具潛力的新型植物保護產品,對我國的糧食安全具有重要的戰略意義。
來源:《農藥學學報》2023年第1期
作者:南京農業大學 植物保護學院 宋修仕 高靜 周明國*







